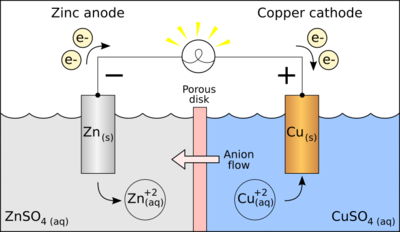
Oksido-redukcione reakcije karakteriše proces primanja i otpuštanja elektrona.
Oksidacioni broj predstavlja merilo oksidacionog stanja atoma koji se menja u oksido-redukcionim procesima.
Oksidacioni broj je neka vrsta uslovne jedinice i pripisuje se pojedinačnom atomu bilo da se nalazi u elementarnom stanju, kao jon ili molekul.
Svi hemijski elementi u elementarnom stanju imaju oksidacioni broj jednak 0 (nuli):O
2, H
2, P
4,
S
8, He.
Svi jednoatomni joni imaju oksidacioni broj koji odgovara njihovom stvarnom naelektrisanju:
Zbir oksidacionih brojeva svih atoma elemenata u molekulu jedinjenja je jednak 0 (nuli):
Zbir oksidacionog broja elemenata u višeatomnim jonima je jednak njihovom stvarnom naelektrisanju:
Pojedini hemijski elementi imaju, uglavnom, uvek isti oksidacioni broj u svim jedinjenjima: -
kiseonik -->
-2 (osim u peroksidima i superoksidima), izuzetak je F
2O gde je oksidacioni broj kiseonika +2.
-
vodonik -->
+1 (osim u hidridima metala)
-
fluor -->
-1
-
metali Ia grupe -->
+1
-
metali IIa grupe -->
+2
Oksido - redukcije
To su reakcije kod kojih dolazi do promene oksidacionog broja.
Oksidacija - otpuštanje elektrona i povećanje oksidacionog broja.
Redukcija - primanje elektrona i smanjenje oksidacionog broja.
Oksidaciono sredstvo - supstanca čiji atom prima elektrone i ima najveći oksidacioni broj.
- supstanca čiji se atom redukuje:KMnO4, K2CrO4,
K2Cr2O7, HNO3, HClO3,
HClO4, H2SO4, MnO2, O2,
PbO2, X2, Mn+, Zn2+
- kod nemetala je jače ono oksidaciono sredstvo koje kao nemetal ima veću elektronegativnost:
- kod jona metala raste oksidaciona sposobnost u nizu:
.Na+, Mg 2+, Al3+, Zn2+,
Sn2+, Cu2+, Ag+, Au+
!!!OKSIDACIONA SREDSTVA DRUGE OKSIDUJU A SAMI SE REDUKUJU!!!
Redukciono sredstvo - supstanca čiji atom otpušta elektrne i ima najmanji oksidacioni broj
- supstanca čiji se atom oksiduje:
-->H
2F
2, CO, NH
3,
H
2S, H
2, CaH
2, X
-, M
- joni nemetala su jača redukciona sredstva ako imaju manji afinitet prema elektronu:
- kod atoma metala raste redukciona sposobnost u nizu: Cu, Sn, Zn, Al, Mg, Na. Ag i Au se ne oksiduju (nisu redukciona sredstva).
!!!REDUKCIONA SREDSTVA DRUGE REDUKUJU A SAMI SE OKSIDUJU!!!
I oksidaciona i redukciona sredstva su supstance čiji atom može da prima i otpušta elektrone (ima srednju vrednost oksidacionog broja):KClO2, HNO2,
H2SO3, SO2, KNO2, H2O2
Vrste oksidoredukcije:
1. Međumolekulske
2. Intramolekulske - dva atoma istog molekula menjaju oksidacioni broj:
3. Reakcije disproporcije - atom iz jednog oksidacionog stanja prelazi u dva različita oksidaciona stanja:
4.
Reakcije rimproporcije: atomi iz dva različita oksidaciona stanja prelaze u jedno isto stanje: