Heterociklična jedinjenja su ona ciklična jedinjenja koja pored ugljenikovih atoma u strukturi prstena sadrže jedan ili više atoma nekih drugih elemenata - heteroatoma (kiseonik, azot, sumpor).
Nomenklatura

Znatan broj heterocikličnih sistema poznat je odavno; ti heteroprstenovi imaju svoja trivijalna imena (pirol, furan...) koja su se zadržala i još uvek se upotrebljavaju.
Po IUPAC-nomenklaturi imena prstenova se izvode kombinacijom prefiksa koji označava vrstu heteroatoma (
oksa- za kiseonik,
tia- za sumpor,
aza- za azot) i sufiksa koji označava veličinu prstena (
-ol za petočlani,
-in za šestočlani prsten).
Ako prsten sadrži dva ista heteroatoma, prefiksi su dioksa, diaza itd. a ako su heteroatomi različiti, kiseonik ima preimućstvo nad azotom (
oksaz-) odnosno sumpor nad azotom (
tiaz-).
Obeležavanje pojedinih atoma u prstenu vrši se brojevima, a numerisanje počinje uvek od heteroatoma; ako ima dva heteroatoma obeležava se u smeru da drugi heteroatom nosi najmanji mogući broj.
Hidrogenizovani prstenovi imaju takođe svoja trivijalna imena; prema novom sistemu, petočlani prstenovi sa azotom dobijaju nastavak
-olidin, a bez azota
-olan; šestočlani prstenovi sa azotom označavaju se kao
perhidro- , a bez azota dobijaju nastavak
-an.
Heterociklični sistemi sa jednim heteroatomom
Imaju aromatična svojstva zbog delokalizacije slobodnog elektronskog para i podležu pre supsticionim nego adicionim reakcijama.
Petočlani heteroprstenovi
 |
| pirol |
 |
| furan |
Pirol i furan nemaju bazne osobine, tj. ne grade soli sa kiselinama već se polimerizuju u smolaste proizvode. Pirol pokazuje slabo kisele osobine: sa KOH nastaje piril-kalijum (dejstvom vode ovo jedinjenje (so) se hidrolizuje u pirol):
Aromatične (elektrofilne) supstitucije:
Furan se ne može direktno halogenovati.
Pirol se može halogenovati bez katalizatora i daje tetrahalogeni-derivat.
Tiofen se ponaša isto kao i benzen, sa sulfatnom kiselinom na običnoj temperaturi gradi tiofensulfonsku kiselinu.
 |
| tiofen |
Derivati furana - furanozni oblici monosaharida (u glikozidima, polisaharidima).
Šestočlani heteroprstenovi
Piridin je analogan benzenu i veoma je postojan prema oksidacionim sredstvima i vrlo teško stupa u aromatične supstitucione reakcije.
Reakcije piridina:
1.Piridin je slaba baza (predstavlja tercijarni amin) i sa kiselinama gradi piridinijum soli:
2. Supstitucija se vrši u meta-položaju:
3. Hidrogenovanje - nastaje piperidin (jača baza od piridina):
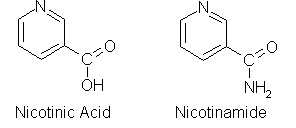
Derivati piridina: alkaloidi (nikotin, kokain, atropin), nikotinska kiselina, nikotinamid, vitamin B6 (piridoksal, piridoksin, piridoksamin).
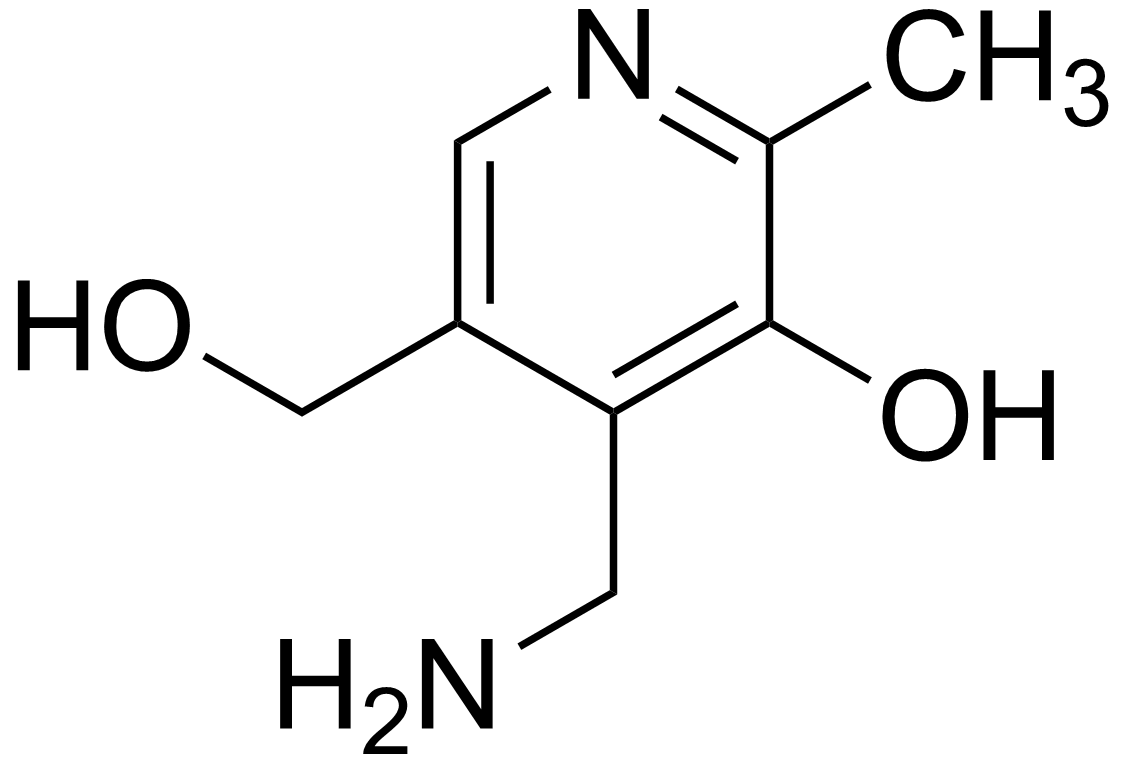 |
| piridoksamin |
 |
| piridoksal | | |
Hidrogenizovani heteroprstenovi
 |
| pirolidin |
 |
| piperidin |
 |
| oksan |
Kao i druga aromatična jedinjenja, petočlani i šestočlani aromatični heterosistemi (furan, pirol, piridin i piran) mogu da se u prisustvu katalizatora (Ni, Pt i Pb) redukuju u odgovarajuće hidrogenizovane sisteme.
Hidrogenizovani prstenovi se ponašaju kao odgovarajuća alifatična jedinjenja (tetrahidropiran i tetrahidrofuran se ponašaju kao etri, a oni koji sadrže azot se ponašaju kao sekundarni amini).
Heterociklični sistemi sa dva i više heteroatoma
 |
| imidazol | |
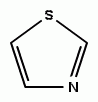 |
| tiazol |
 |
| pirimidin |
 |
| purin |
Imidazol
Pokazuje aromatičan karakter; jedan azot ima osobine pirola a drugi piridina, tako da imidazol pokazuje slabo bazne osobine.
Imidazolov prsten nalazi se u prirodnoj aminokiselini histidinu:
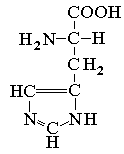 |
| histidin |
Tiazol
On je strukturno sličan tiofenu i piridinu. Vrlo je postojan prema oksidacionim i redukcionim sredstvima, relativno teško podleže aromatičnim supstitucijama i može se reći da je neaktivan.
Derivati: sulfatiazol, tiamin (vitamin B1) i penicilin.
 |
| sulfatiazol |
 |
| vitamin B1 |
Pirimidin
On je heteroprsten od najveće važnosti. Ima aromatične osobine i slabo bazan karakter.
Derivati: citozin (C), uracil (U), timin (T), 5-metilcitozin, barbiturati (soli barbiturne kiseline).
 |
| barbiturna kiselina |
 Purin
Purin
Sastoji se iz jednog pirimidinskog prstena kondenzovanog sa imidazolovim.
Derivati: adenin (A), guanin (G), ksantin (i njegovi metilovani derivati - teofilin, kofein, teobromin), mokraćna kiselina.
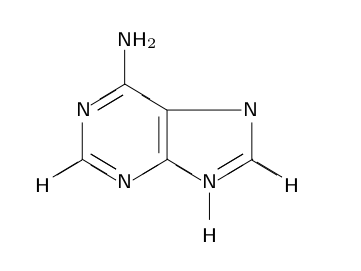 |
| adenin |

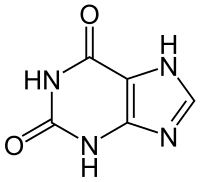 |
| ksantin |
 |
| teofilin |
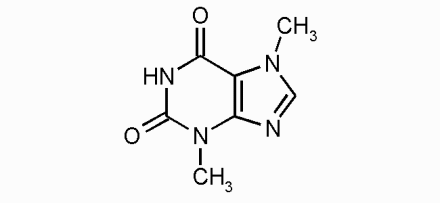 |
| teobromin |
 |
| mokraćna kiselina |
 Znatan broj heterocikličnih sistema poznat je odavno; ti heteroprstenovi imaju svoja trivijalna imena (pirol, furan...) koja su se zadržala i još uvek se upotrebljavaju.
Znatan broj heterocikličnih sistema poznat je odavno; ti heteroprstenovi imaju svoja trivijalna imena (pirol, furan...) koja su se zadržala i još uvek se upotrebljavaju.

 Znatan broj heterocikličnih sistema poznat je odavno; ti heteroprstenovi imaju svoja trivijalna imena (pirol, furan...) koja su se zadržala i još uvek se upotrebljavaju.
Znatan broj heterocikličnih sistema poznat je odavno; ti heteroprstenovi imaju svoja trivijalna imena (pirol, furan...) koja su se zadržala i još uvek se upotrebljavaju.