Dipolni momenat
Elektronski dipolni momenat: uv = q * l, um = ∑ * uv
Polarnost višeatomnih molekula zavisi od njihvog oblika:
1. linearan - nepolaran molekul - CO2, CS2, CCl4
2. savijen - polaran molekul - SO2, H2O
3. pirimidalan - SO3, NH3
 |
| Polaran molekul |
 |
| Nepolaran molekul |
Polarnost molekula
Do polarizacije veze dolazi kada se zajednički elektronski par nalazi u sveri atoma koji ima veći afinitet prema elektronu i jače ga ptivlači.
Polarnost se može odrediti i na osnovu ∆ χ vezanih atoma (elektronegativnost -χ- na osnovu PSE):
1. ∆ χ = 0 - nepolarna kovalentna veza
2. 0 < ∆ χ < 1,7 - polarna kovalentna veza
3. ∆ χ > 1,7 - jonska veza
Kristalni sistemi
Materijalne ( kristalne) sisteme možemo klasifikovati u nekoliko grupa:
1. molekulski kristali - led, čvrsti CO2, čvrti HCl, beli fosfor;
2. atomski kristali - Si, dijamant, crveni fosfor;
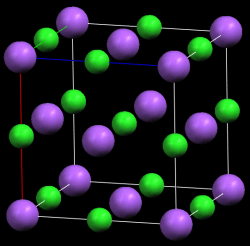
3. jonski kristali - NaCl, ZnCl2, NaNO3;
4. metalni kristali - Au, Ag, Cu, Zn, Fe;
Neke supstance u čvrstom stanju nemaju kristalne strukture, već predstavljaju takozvane amforne supstance (amforni sumpor, amgorni ugljenik, proteini nerastvorni u vodi, staklo, razne vrste smola itd.).
Od svih kristalnih sistema najstabilniji su jonski sistemi zbog veoma jakih jonskih (elektrostatičkih) privlačnih sila. Od molekulskih kristala su stabilniji oni koji grade polarne supstance.
Izgradnja kristala
Kristali imaju određeni geometrijski oblik, poput geometrijskih tela čije su ravni pod tačno datim uglom. Ovaj ugao je karakterističan za određenu vrstu kristala. Spoljašnji geometrijski oblik kristala uslovljen je unutrašnjom strukturom - pravilnim rasporedom strukturnih jedinica koje mogu biti joni, atomi ili molekuli. Najmanji deo kristala se zove elementarna ćelija kristala.Povezivanjem elementarnih ćelija kristal "raste" i najstaje kristalna (prostrana) rešetka.
Нема коментара:
Постави коментар