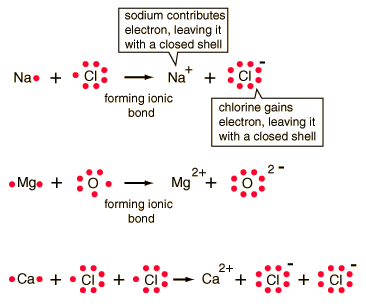
Jonska veza
Jonsku vezu grade atomi metala i nemetala.
ili
Jonska veza se uspostavlja između elemenata koji se nalaze na levoj strani PSE (alkalni i zemnoalkalni metali) i elemenata iz gornjih delova desne strane PSE (halogeni elementi).
Atomi na levoj strani PSE imaju najnižu energiju jonizacije, a atomi elemenata na desnoj strani PSE imaju najveći afinitet prema elektronu..
Prečnik pozitivnih jona opada a negativnih raste u odnosu na neutralne atome, tako rastu i privlačne sile.
Jonska jedninjenja se u kristalnoj rešetci nalaze u obliku jona a ne molekula.
Svojstva: čvrste kristalne supstance, rastvorljive u vodi ako im je kristalna rešetka nestabilna ( NaOH, Ca(OH)2 ). Imaju visoke tačke topljenja, rastopi i rastvori provode struju.
Vodonična veza
Javlja se između molekula koji sadrže vodonik vezan za atom velike elektronegativnosti: O, F, N. Obeležava se isprekidanim crticama. Znatno je slabija od jonske i kovalentne veze.
Vodonična veza koju grade N i O u nukleinskim kiselinama omogućava nastajanje i funkcionisanje najsloženijih jedinjenja (makromolekula) - nosilaca života.
Primeri: H2O, R-COOH, R-OH, NH3, R-NH2,
HF, H2F2
Metalna veza
Privlačne veze između jona metala i slobodnih elektrona u kristalnoj rešetci metala. Jačina metalne veze zavisi od broja elektrona koji je grade i gustine pakovanja kristalne rešetke. Manifestuje se preko tačke topljenja: Tt (Cs) = 28,9oC
Tt (W) = 3460oC
Van der Valsove privlačne sile
Vrlo slabe privlačne sile između polarnih i nepolarnih molekula. Manje utiču na tačku ključanja od vodonične veze.Tačka ključanja opada sa većom molarnom masom.

Нема коментара:
Постави коментар