Ciklični ugljovodonici alifatičnog karaktera (označava hemijsko ponašanje slično alkanima, alkenima ili alkinima i njihovim derivatima) poznati kao aliciklični (alifatično-ciklični) mogu niti zasićeni (cikloalkani) i nezasićeni (cikloalkeni i cikloalkini).
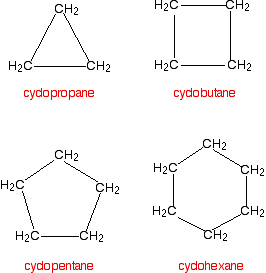
Cikloalkani
Cikloalkani su zasićeni ugljovodonici kod kojih su C-atomi vezani jednostrukim vezama.Opšta formula:
Nomenklatura - cikloalkani se nazivaju tako što se ispred imena alkana sa istim brojem C-atoma stavlja prefiks ciklo-.
Dobijanje: 1) iz prirodnih izvora (nafta, etarska ulja),
2) hidrogenovanjem aromatičnih ugljovodonika:
3) dehalogenovanjem dihalogenskih derivata alkana (reakcija ciklizacije):
Fizičke osobine - vrlo su slične fizičkim osobinama alkana. Tačke ključanja se povećavaju sa povećavanjem broja C-atoma.
Hemijske osobine - cikloalkani pokazuju iste hemijske osobine kao i alkani, s tom razlikom što su mali prstenovi (ciklopropan i ciklobutan) reaktivniji od ostalih prstenova.
Reakcije:
A) Ciklopropan:
1. adicija vodonika u prisustvu katalizatora (Ni):
2. adicija broma (bromovodonika):
B) Ciklobutan:
1. ne reaguje sa bromom na običnoj temperaturi
2. reaguje sa vodonikom, uz prisustvo katalizatora (Ni) na temperaturi od 200 stepeni Celzijusovih:
C) Ciklopentan i cikloheksan ne reaguju sa vodonikom ni na temperaturama iznad 200 stpeni Celzijusovih i podležu istim reakcijama kao i alkani :
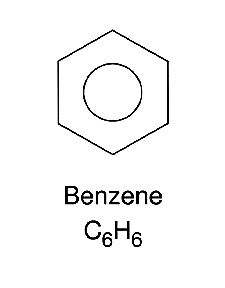
Areni (aromatični ugljovodonici)
To su ciklična jedinjenja. Najprostiji aromatični ugljovodonik jeste benzen.
Šest ugljenikovih atoma nalazi se vezano u obliku pravilnog šestougaonika, a za svaki ugljenikov atom vezan je po jedan vodonikov atom, da bi ugljenikovi atomi bili četvorovalentni, prsten sadrži naizmenično raspoređene tri dvostruke veze.
Članovi homologog reda se nazivaju ili uobičajenim imenima ili kao derivati benzena:
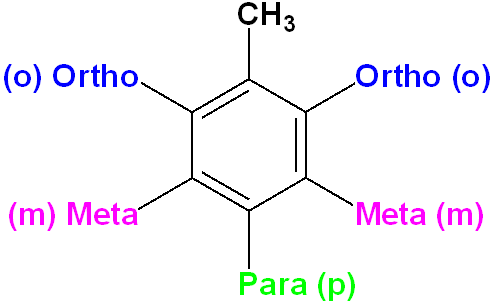
Supstituisani benzenov prsten se obeležava brojevima tako da su grupe vezane za prsten označene što nižim brojem.
Jednovalentne ugljovodonične grupe aromatičnih ugljovodonika (arena) koje se izvode oduzimanjem jednog H-atoma vezanog za prsten nazivaju se opštim imenom aril-grupe i obeležavaju se sa Ar-. Grupa koja se dobija oduzimanjem jednog H-atoma iz benzena naziva se fenil-grupa.
Dobijanje: 1) iz prirodnih izvora (nafta, ugalj),
2) dekarboksilovanjem aromatičnih kiselina ili njihovih soli:
 |
| onaj hlor što visi u vazduhu je zalutao na ovoj slici :) |
Fizičke osobine - areni su tečnosti ili čvrste supstancije koje se ne rastvaraju u vodi i koje su lakše od vode. Tečni areni su zapaljivi i zbog velikog procenta ugljenika gore čađavim plamenom.
Reakcije:
A) Supstitucija (elektrofilna)
1. Halogenovanje - dejstvo hlora ili broma na benzen u prisustvu katalizatora (Fe):
2. Nitrovanje - dejstvom smeše koncentrovane nitratne i sulfatne kiseline (katalizator) na bezen na 50 stepeni supstituiše se jedan H-atom:
3. Sulfonovanje - dejstvo koncentrovane sumporne kiseline na benzen:
4. Alkilovanje - u prisustvu anhidrovanog aluminijum-hlorida kao katalizatora , benzen reaguje sa haloalkanima ili alkil-halogenidima gradeći alkilbenzen:
5. Acilovanje - kada acil grupa u aromatičnom prstenu zameni jedan vodonikov atom , tada takve reakcije nazivamo reakcijama acilovanja. Ove reakcije se vrše tako što benzen reaguje sa acil-halogenidom (RCOCl) u prisustvu anhidrovanog aluminijum-hlorida, dajući pri tome aromatične ketone:
Supstituienti koji povećavaju reaktivnost benzenovog prstena nazivaju se aktivirajući, a supstituenti koji ga čine manje reaktivnim dezaktivirajući.
Aktivirajući supstituenti usmeravaju dalju supstituciju u orto i para položaj. Dezaktivirajući supstituenti usmeravaju dalju supstituciju u meta položaj.
Aktivirajući supstituenti:
Jako: -NH2
-OH
Srednje: -OCH3 (-OC2H5,
itd.)
-NHCOCH3
-NHCOCH3
Slabo: -C6H5
-CH3 (-C2H5, itd.)
-CH3 (-C2H5, itd.)
Dezaktivirajući supstituenti:
-NO
-N(CH3)3+
-CN
-COOH (-COOR)
-SO3H
-CHO, -COR
B) Adicione reakcije - izvode se pod određenim uslovima
















Нема коментара:
Постави коментар