Agregatna stanja materije
Atomi su osnovne strukturne jedinice materije. To su najmanje čestice hemijskog elementa koje mogu učestvovati u različitim kombinacijama međusobnog povezivanja pri hemijskim reakcijama. Jednoj atomskoj vrsti odgvara tačno jedan hemijski element.
Kada se po dva ili više atoma iste ili različitih vrsta međusobno povežu (hemijskim putem) onda nastaju nove čestice koje se nazivaju molekuli. Kada su atomi iste vrste sjedinjeni nastaju molekuli elementa, a u suprotnom molekuli jedinjenja.
U zavisnosti od uslova (kohezione sile, pritisak i temperatura) supstance u prrodi mogu postojati u tri osnovna agregatna stanja materije: u gasovitom, tečnom i čvrstom. Prelaz supstance iz jednog u drugo agregatno stanje praćen je povećanjem ili smanjenjem rastojanja među molekulima, ali se priroda supstanci ne menja.
Gasovito agregatno stanje (g) materije se odlikuje haotičnim kretanjem molekula sa velikim brzinama uz mnoštvo međusobnih sudara. Privlačne sile među molekulima daleko su slabije nego u tečnom i čvrstom agregatnom stanju. Haotično kretanje je razlog što gasovite supstance nemaju stalan oblik i zapeminu, vać zauzimaju oblik suda u kom se nalaze.
Tečno agregatno stanje (l) nastaje ili kondenzovanjem gasovitih supstanci ili topljenjem čvrstih supstanci. I molekuli tečnosti se haotično kreću ali u daleko manjem stepenu nego što je to slučaj sa gasovima. Tečnosti imaju stalnu zapreminu.
Čvrsto agregatno stanje (s) karakteriše se stalnim oblikom i stalnom zapreminom tela koja su izgrađena od jedne ili više različitih supstanci. Čestice (molekuli, atomi i joni) koje izgrađuju čvrsto agregatno stanje povezane su međusobno veoma jakim privlačnim silama. U većini slučajeva čiste čvrste supstance imaju pravilan geometrijski oblik koji se ispoljava u vidurazličitih klasa kristala.
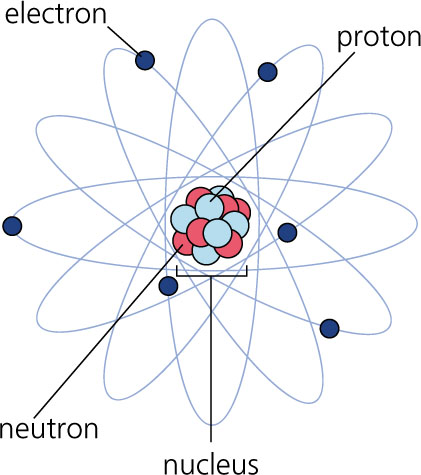
Struktura atoma
Atom se sastoji od pozitivno naelektrisanog jezgra i elektronskiog omotača koji sadrži istu količinu negativnog naelektrisanja, te je atom u celini elektroneutralan.
N(p+) = N(e-)
Jezgro atoma se nalazi u središtu atoma i sastoji se od protona i neutrona koje jednim imenom nazivamo nukleoni.
Svaki atom je definisan atomskim brojem (Z) i masenim brojem (A).
Broj protona u jezgru nekog atoma jednak je atomskom broju tog elementa: Z = N(p+).
Zbir protona i neutrona u jezgru daje maseni broj: A = N(p+) + N(n)
Broj neutrona jednak je razlici masenog i atomskog broja: N(n) = A - Z
Izotopi - atomi istog elementa koji imaju isti broj protona, a različit broj neutrona, tj. to su isti elementi koji imaju isti redni broj (Z), a različiti maseni broj (A).
Izobari - atomi različitih elemenata čiji je zbir protona i neutrona jednak, tj. to su elementi koji imaju isti maseni broj (A), a različiti redni broj (Z).
Izotoni - atomi različitih elemenata koji imaju jednak broj neutrona.
Нема коментара:
Постави коментар