Geometrijski oblik molekula - hibridizacija
Prema teoriji i metodi valentne veze geometrijski oblik molekula, pa time i usmerenost valenci u prostoru posledica je preklapanja atomskih orbitala koje je utoliko povoljnije ukoliko može dostići maksimalnu vrednost.
6C 1s22s22p6
sp3 hibridizacija
U sp3 hibridizaciju uključena je jedna s i tri p-orbitale istog atoma. Kao rezultat hibridizacije nastaju četiri sp3 hibridizovane orbitale.
Četiri sp3 hibridizovane orbitale imaju oblik nepravilne izdužene osmice, usmerene širim delom ka rogljevima pravilnog tetraedra. Raspoređene su pod uglom od 109,5o.
H2O - 104,5o
NH3 - 107o
H2O - 104,5o
NH3 - 107o
H2O
H2O –
sp2 hibridizacija
U hibridizaciju je uključena jedna s i dve p-orbitale istog atoma, dok jedna p-orbitala ostaje nehibridizovana. nastaju tri sp2 hibridizovane orbitale koje se nalaze pod uglom od 120o dok je nehibridizovana p-orbitala postavljena normalno u onosu na njih.
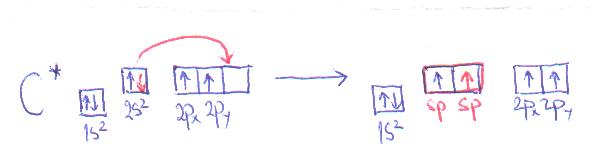
sp hibridizacija
U hibridizaciju je uključena jedna s i jedna p-orbitala, dok dve p-orbitale ostaju nehibridizovane. Kao rezultat hibridizacije nastaju dve sp hibridizovane orbitale, koje se nalaze pod uglom od 180o, Dve nehibridizovane p-orbitale su postavljene normalno u odnosu na hibridizovane orbitale i međusobno. Nastaju jedna sigma i dve pi-veze.







Нема коментара:
Постави коментар