Rastvori su homogene smeše koje imaju isti sastav u svakom delu svoje zapremine.
Uobičajeno je da se jedna komponenta rastvora naziva rastvarač a druga rastvorak ili rastvorna supstanca.
Pravi rastvori se dele prema agregatnom stanju:
Jako polarni molekuli vode se čsto toliko vezuju za čestice rastvorene
supstance, da pri ponovnoj kristalizaciji ulaze u sastav kristala -
krade kristalohidrate
(Na2CO3 * 10H20
). Stajanjem na vazduhu gub tzv. kristalnu vodu i
pretvaraju se u prah. Kristalohidrat koji je potpuno izgubio vodu jeste
anhidrovana supstanca (Na2CO3).
Uobičajeno je da se jedna komponenta rastvora naziva rastvarač a druga rastvorak ili rastvorna supstanca.
Disperzni sistemi
Pod sistemom se podrazumeva deo prostora koji se izučava ispunjen jednom ili više supstanci, ograničen stvarnim ili zamišljenim granicama. Sve izvan sistema naziva se okolina. Postoje otvoreni, zatvoreni i izolovani sistemi.
Disperznim sistemom nazivamo sistem u kojem je disperzna faza ravnomrno raspoređena u drugoj fazi, koju nazivamo disperznim sredstvom. I disperzna faza i disperzno sredstvo mogu biti gasovi, tečnosti ili čvrste supstance.
Prema veličini čestica disperzne faze, disperzni sistemi se dele na:
1) grubo disperzne sisteme - čestice su veće od 100nm (heterogeni sistemi).
2) koloidno disperzne sisteme - veličine čestica su od 1 do 100nm (heterogeni sistemi).
3) molekulsko disperzne sisteme - čestice su manje od 1nm, to su homogeni (monofazni) sistemi i nazivaju se rastvori.
Suspenzije i emulzije spadaju u grubo disperzne sisteme. Kod suspenzija diperzna faza se izdvaja u obliku taloga, tj. diperzna faza je čvrsta. A kod emulzija i disperzna faza i disperzno sredstvo su u tečnom stanju, ali se međusobno ne mešaju.
Pravi rastvori
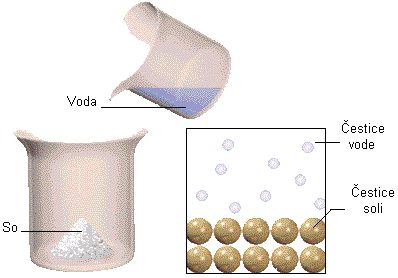
Pravi rastvori su homogene smeše dve ili više supstanci. Sastoje se rastvarača i rastvorne supstance.
Pravi rastvori se dele prema agregatnom stanju:
Solvatacija je proces kada molekuli rastvarača okružuju čestice rastvorka zbog privlačnih sila. Solvatizovane čestice su odvojene jedne od drugih. Tokom solvatacije se oslobađa toplota, pa je proces egzoterman.
Ako je voda rastvarač onda se ovaj proces naziva hidratacija.
Istovremeno sa procesom rastvaranja u rastvorima se odigrava i suprotan proces - kristalizacija.
Kada se u jedinici vremena na određenoj temperaturi rastvori isti broj molekula koliko ih i iskristališe, tada se rastvorena supstanca nalazi u ravnoteži sa svojim ne rastvorenim kristalima - rastvori je zasićen. Ako rastvor sadrži više rastvorene supstance u istoj zapremini nego što odgovara zasićenom rastvoru, na određenoj temperaturi, nastaje presićen rastvor. Nezasićen rastvori sadrže manje rastvorne supstance u istoj zapremini nego što odgovara zasićenom rastvoru na određenoj temperaturi.
Rastvorljivost
Rastvorljivost predstavlja maseni odnos rastvorene supstance i rastvarača u zasićenom rastvoru na određenoj temperaturi.
Obično se izražava kao masa supstance koja se rastvara (rastvorka) u 100g rastvarača (dajući zasićen rastvor) na određenoj temperaturi.
Rastvorljivost čvrste supstance u određenom rastvaraču zavisi od temperature.
Sastav rastvora
Sastav rastvora kvalitativno se može izraziti tako što se naznači da li je razblažen ili koncentrovan. Kvantitativni sastav rastvora se najčešće izražava količinskom koncentracijom.
Maseni udeo - predstavlja udeo mase rastvorene supstance u ukupnoj masi rastvora:
Koncentracija rastvora - veličina koja pokazuje koja se masa, odnosno zapremina, količina supstance ili broj čestica rastvorka nalazi u određenoj zapremini rastvora.
1) količinska koncentracija (molaritet):
*za jako razblažene rastvore C = b
Razblaživanje rastvora:
V1 < V2
m(X1) = m(X2)
C1 > C2 W1 * mr1
= W2*mr2
Vr2 = Vr1
+ V (H20)
Uparavanje rastvora:
V1 > V2
m(X1) = m(X2)
C1 < C2 W1 * mr1
= W2*mr2
Vr2 = Vr1
- V (H20)
Mešanje rastvora:









Нема коментара:
Постави коментар